关于药用辅料关联审批说明
- 分类:公司新闻
- 作者:
- 来源:
- 发布时间:2018-09-11 11:33
- 访问量:
关于药用辅料关联审批说明
- 分类:公司新闻
- 作者:
- 来源:
- 发布时间:2018-09-11 11:33
- 访问量:
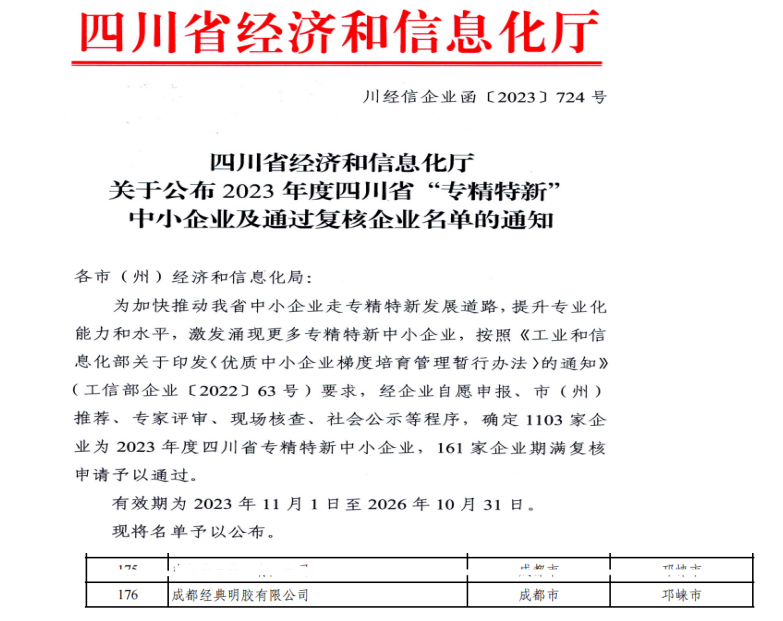
我公司于2016年9月13日获得了四川省食品药品监督管理局签发的药品生产许可证,在同年8月10日,国家食品药品监督管理总局发布了——总局关于药包材药用辅料与药品关联审评审批有关事项的公告(2016年第134号),该公告指出为简化药品审批程序,将直接接触药品的包装材料和容器(以下简称药包材)、药用辅料由单独审批改为在审批药品注册申请时一并审评审批。自本公告发布之日起,药包材、药用辅料应按程序与药品注册申请关联申报和审评审批。各级食品药品监督管理部门不再单独受理药包材、药用辅料注册申请,不再单独核发相关注册批准证明文件。
在2017年11月30日,国家食品药品监督管理总局发布了——总局关于调整原料药、药用辅料和药包材审评审批事项的公告(2017年第146号),该公告发布之日起,各级食品药品监督管理部门不再单独受理原料药、药用辅料和药包材注册申请,取消药用辅料与直接接触药品的包装材料和容器(以下简称药包材)审批。
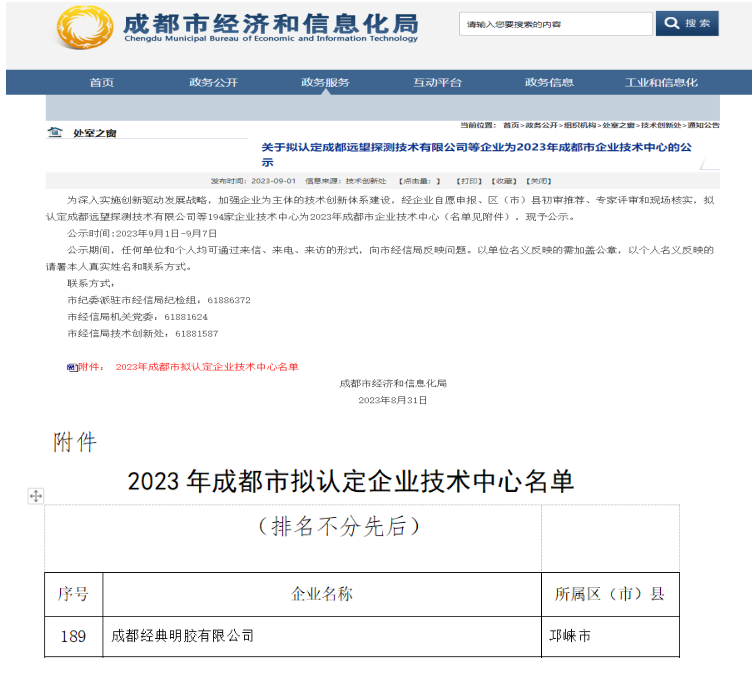
所以我公司在拿到药品生产许可证后按照上诉,没有申报生产注册批件,直接按照新规进行了“原辅包登记”,与2018年3月8号在原辅包登记平台(www.cde.org.cn)提交电子登记资料后获得登记号,登记号为:F20180000548。并根据药用辅料申报资料要求(2016年第155号文)撰写申报资料,将资料邮寄至国家食品药品监督管理总局药品审评中心,药审中心对我公司审核资料符合要求后,在“药用辅料数据库”公示了我公司登记号等相关信息。可登录国家食品药品监督管理总局药品评审中心的官网(www.cde.org.cn),在主页右侧热点栏目中的原料药、药用辅料和药包材登记信息公示可查询相关信息。
在与制剂厂家供货合作时,按照总局《关于发布药包材药用辅料申报资料要求(试行)的通告》(2016年第155号),将药用辅料和药包材与制剂一并审评。总局根据需要组织核查单位对该制剂使用的原辅包启动现场检查和注册检验工作,现场检查和注册检验应当符合相关规定。
在于原料药、药用辅料、药包材厂家供货合作时直接提供我公司在登记平台公示的登记信息,厂家审查符合要求录入供应商即可。
特此说明
成都经典明胶有限公司
2018年5月31日
CONTACT INFORMATION
联系方式
MOBILE WEBSITE
手机网站
欢迎访问我们手机网站

ONLINE MESSAGE
联系方式
Copyright © 2021 成都经典明胶有限公司 All Rights Reserved 蜀ICP备11002324号-1 本站支持IPV6